3月2日,山东大学基础医学院孙金鹏教授研究团队、于晓教授研究团队,山东大学第二医院冯世庆教授和浙江大学张岩教授团队联合攻关,在Science杂志在线发表了题为 “Unsaturated bond recognition leads to biased signal in a fatty acid receptor”的研究论文。浙江大学研究员毛春友、博士研究生秦娇,山东大学基础医学院教授肖鹏,博士研究生陶晓娜、张超;山东大学齐鲁医院博士后贺庆涛为本文共同第一作者;孙金鹏教授、张岩教授、于晓教授、冯世庆教授为文章共同通讯作者。
鱼油含有丰富的高不饱和脂肪酸,包括ω-3脂肪酸中的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),一直以来鱼油因其特殊的保健功效而被广泛应用,可以预防心血管疾病、癌症、和阿尔茨海默病等。此外,鱼油中的脂肪酸还被认为可以用于治疗其他疾病,包括肥胖、2型糖尿病、抑郁症、非酒精性脂肪肝和炎症等。据统计,早在2021年,全球鱼油市场规模为23亿美元,预计到2030年,鱼油市场规模将达到218亿美元。因此,发展高亲和力的鱼油替代品刻不容缓。
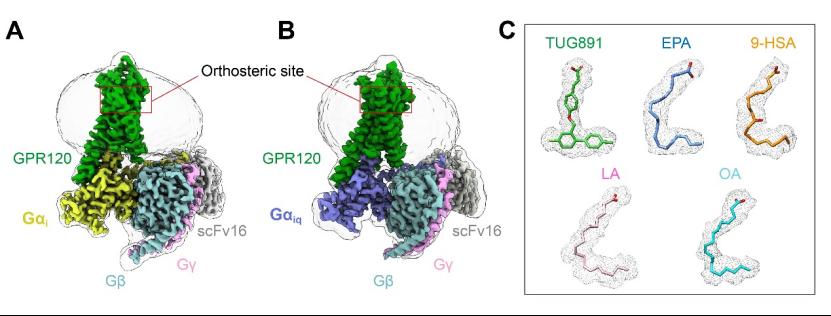
图1:GPR120-Gi/Giq复合体及配体电子密度
鱼油中改善代谢的ω-3脂肪酸能够特异的被细胞膜上的游离脂肪酸受体4 (FFAR4),又称为GPR120所识别。GPR120是一种能够被长链脂肪酸酸识别的G蛋白偶联受体,是糖尿病的重要药物靶点。孙金鹏教授和于晓教授团队在前期研究中发现胰岛δ细胞上的GPR120通过感知内源性脂肪酸配体油酸(OA)和亚油酸(LA),抑制SST分泌,进而促进β细胞的胰岛素分泌,并且具有改善胰岛炎症,维持胰岛稳态的功能,相关成果2022年发表在糖尿病杂志Diabetes。有趣的是,OA和LA的不饱和双键位于脂肪酸链的不同位置,其是否和他们在体内完全不同的功能有关,是很有意思的谜题。进一步探究脂肪酸受体如何识别不同的不饱和脂肪酸类型,并产生具体的信号功能,成为亟需解决的脂肪酸信号转导和代谢的重要科学问题。
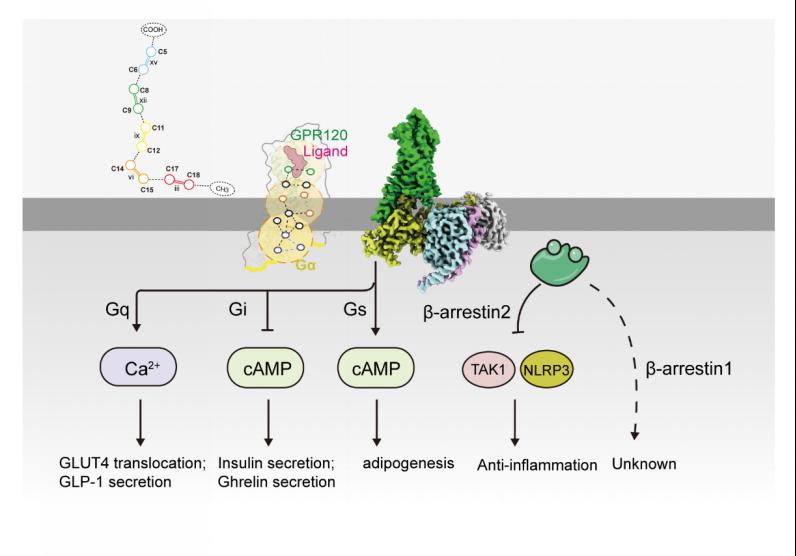
图2:膜受体GPR120特异性识别不饱和脂肪酸的碳碳双键,不同脂肪酸在GPR120结合口袋内部的不同作用模式通过特定的信号转导传播路径来发挥不同的生物学功能
本项研究进行了系统药理学分析,结合结构生物学,计算生物学和细胞功能实验,阐明GPR120受体内的芳香族氨基酸可以通过π-π作用识别特定的双键,进而影响不同的下游信号转导。该研究采用冷冻电镜技术解析了多个不同的脂肪酸配体与GPR120-G蛋白复合物的高分辨率冷冻电镜结构(图1),填补了长链脂肪酸识别G蛋白偶联受体领域的空白,揭开了脂类受体GPR120激活G蛋白的神秘面纱。研究发现这些脂肪酸,尤其是不同位置具有双键的脂肪酸对GPR120下游各信号通路具有不同的偏好性,且只有ω-3脂肪酸具有Gs活力。进一步分析提出了GPR120的芳香族氨基酸识别不饱和脂肪酸双键的机制,并使用了生物化学与计算生物学等多种方法进行了详细探究。尤其是通过比对GPR120结合不同脂肪酸分子的复合物结构,发现GPR120的配体口袋内共有9个芳香族氨基酸参与了不同位置双键的特异性识别。通过对比GPR120偶联不同G蛋白亚型复合物结构,发现了影响GPR120下游信号通路偏好性的氨基酸以及潜在的途径,揭示了GPR120 的芳香氨基酸可以与不饱和脂肪酸双键形成π:π 相互作用并通过识别不饱和脂肪酸特定位置的双键将特异信号转导至不同下游信号通路从而发挥不同的生理功能(图2)。此外,研究还发现TUG891选择性识别GPR120的结构基础以及GPR120的疾病相关SNP位点的结构基础。这些发现为推动开发精准靶向GPR120的新型高效不饱和脂肪酸类药物提供了理论依据和结构基础,同时为糖尿病、肥胖以及炎症等疾病的药物开发和治疗带来新的曙光,为发展高亲和力的鱼油替代品指明了方向。
研究得到山东大学齐鲁医院张澄教授的指导与支持。冯世庆教授团队长期致力于脊柱脊髓损伤、骨质疏松和骨关节炎的相关研究,2019年启动了鱼油受体在骨科相关创伤性和退行性疾病中的研究,发现特异性激活鱼油受体的偏好性通路可以有效地改善脊髓损伤后微环境失衡,同时对骨质疏松和骨关节炎的疾病进程有显著的改善作用,并通过共同指导学生与于晓教授和孙金鹏教授团队开展了广泛的药理学和结构生物学合作。于晓教授和张澄教授针对动脉粥样硬化性心血管疾病(ASCVD)的发生机制和干预策略进行了深入研究,GPR120可以通过调控下游不同信号通路,发挥促进脂肪酸代谢、降低炎症风险、改善心血管功能等作用,发现GPR120是ASCVD的新型干预靶点,本研究为GPR120作为抗ASCVD的新药开发奠定了基础。
孙金鹏教授课题组长期从事膜受体G蛋白偶联受体(GPCR)的细胞信号转导和微观环境药理学研究,发现了GPR97是糖皮质激素的膜受体以及识别类固醇激素的膜受体家族,鉴定了多个GPCR受体的内源性配体,阐明GPCR对痒觉机械力感知的机制,创新性地提出了GPCR磷酸化编码的“笛子模型”,多聚脯氨酸码头分选及别构建调控理论等,相关工作以通讯作者发表在Nature (5篇),Science, Cell, Cell Metabolism, Nat Chem Biol (2篇),PNAS(4篇),Cell Research (2篇)等。
于晓教授课题组长期聚焦于胰岛稳态的作用及调节机制,阐明了跨膜信号转导对胰岛β细胞分泌功能及胰岛稳态的精确调控机制,包括GPCR下游偏好性信号途径和第二信使的信号时序等(Cell Metab. 2022,Nature 2020,EMBO Reports 2021,eLife 2018,Nature Commun 2021);揭示了胰岛中δ-β细胞环路在胰岛稳态维持中的重要作用(Science.2023,Diabetes. 2022,J Clin Invest. 2017,Cell Discov. 2020,Cell Death Dis. 2018);开发了选择性调节G蛋白偶联受体和PEST磷酸酶亚家族活力来对胰岛稳态失衡发展新的干预策略(Nature 2022, Cell 2021 , PNAS 2022a, 2022b, 2021, Cell Research 2014, Cell Reports 2016)等。
本研究得到国家重点研发计划基金、国家杰出青年科学基金、国家优秀青年科学基金、自然基金委重点基金和山东省优秀青年基金等基金项目的支持。
文章链接:https://www.science.org/doi/10.1126/science.add6220